著者:中道 真理子(社会医療法人 原土井病院)
薬物療法において、栄養状態との関連性を無視することはできません。口から体に入って作用するものは、大きく分けて「食べ物」と「薬」の二つです。摂食・嚥下や消化吸収の問題、さらには認知機能の低下など、栄養状態を左右するさまざまな要因に薬が深く関係しています。一方で、リハビリテーション(以下、リハ)は「薬」とは全く異なる領域として捉えられがちです。その背景には、リハへの介入を行う際には薬物療法がすでに安定していることが前提とされる臨床上の構造があります。しかし、薬物療法を健康状態の一部として捉える「リハ薬剤」の概念(図1)1)では、薬は生活機能・環境因子・背景因子から相互に影響を受ける流動的な存在です。リハの臨床現場においても、薬物療法への流動的な介入は不可欠です。特に高齢者では薬物療法の変化(流動性)は速く、その対応が遅れることで障害の増悪を招くおそれがあります。薬物療法の多くは内服治療であり、服薬管理は患者自身が担う生活に密着した行為です。薬は生活の一部であり、生活機能を評価するリハとの協働は極めて有益であると考えられます。
図1)国際生活機能分類(ICF)と薬剤

高齢者処方が抱える問題点
高齢者の内服処方における問題点の一つに、「ポリファーマシー」があります。ポリファーマシーとは直訳すると「複数の薬」を意味しますが、確立した定義はなく、複数の薬剤使用により有害事象のリスクに曝されている状態を指します。ポリファーマシーの有病率は、年齢層、定義、医療環境、地域によって異なりますが、約4%〜約96.5%の範囲とされ、年齢が上がることで高くなることが予想されています2)。ポリファーマシーは、フレイル、入院、さらには死亡率などの多くの悪影響を伴う臨床的転帰と関連づけられています。
2016年の診療報酬では、「薬剤総合評価調整加算」が新設されました。新設時は、6種類以上の内服薬が処方されている患者が2種類以上減薬した場合に退院時に加算されました。2020年には減薬だけではなく、多職種によるポリファーマシーカンファレンスを行った場合にも算定される2段階の評価となりました。さらに2024年には多職種によるポリファーマシーカンファレンスが緩和され、ポリファーマシー対策に対する診療報酬の後押しが加速しています。
2018年には厚生労働省より「高齢者の医薬品適正使用の指針」が発表されています。薬物療法を適正化するためには、高齢者総合機能評価(Comprehensive Geriatric Assessment;CGA)を用いることが推奨されました。CGAでは、認知機能や日常生活動作(Activities of Daily Living;ADL)、生活環境、患者の薬剤選択嗜好などを評価することで、臓器障害や機能障害、服用管理能力の把握につながるとしています。リハ薬剤においても、国際生活機能分類(International Classification of Functioning, Disability and Health;ICF)を用いてリハ薬剤推論をすることが推奨されています。
このように、薬物療法の見直しを行う場合には、対象者の生きることの全体像を捉えることが求められるようになりました。生きることの全体像を捉えるためには、生活を評価することが得意な職種と協働することが近道です。医師、看護師、薬剤師だけではなく、管理栄養士、セラピスト、ソーシャルワーカーなど様々な視点により、対象者の生活を立体的に把握できます。
栄養やリハによる包括的戦略と薬物療法
ポリファーマシーを有する高齢者には、multimorbidity(2つ以上の慢性疾患の病態)が存在します3)。Multimorbidityは、加齢とともに増加し、65歳以上の人の3分の2に見られます。特に入院患者では多くなります。Multimorbidityという概念は、患者が複数の健康問題を抱えており、それらを個別に治療するべきではないという認識の高まりをもたらしました。さらに、より全人的で患者中心のケアを動機付けています。しかし、「診断数に焦点を当てている」という点で、診断の数で健康問題をとらえています4)。これは、薬剤数のみに焦点を当てた場合のポリファーマシーと類似しており、“数”を数えることが機能レベルや症状を反映しないことが指摘されます。患者中心のケアを推進するために、患者の生活(食事・排泄・活動)を考慮する必要があります。
多疾患を有する入院患者への栄養サポートとして、ESPENのガイドラインでは薬物療法を考慮することが示されています5)。薬の数が増えるほどに、薬物間および薬物―栄養素相互作用のリスクが高まることが指摘されています。薬物-栄養素相互作用では、栄養管理に関わる成分が薬の効果に影響を与える場合があります。また、特定の薬の作用による食欲不振などの副作用や、食欲不振を改善する目的で処方された薬による別の副作用などが懸念され、結果的に栄養摂取量を低下させることがあります。
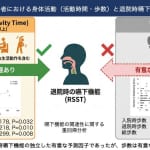
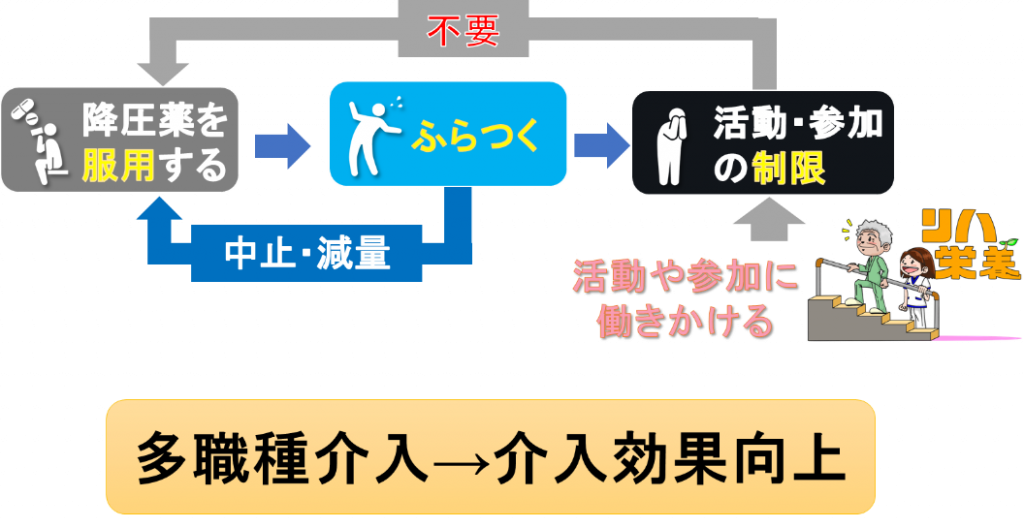
健康成果を高め多剤併用を減らす戦略として、「運動」が示唆されています6)。運動の中心的役割は、抑うつ、不安、不眠症、変形性関節症、認知症などです。運動は、効果が低い、または安全性が低い薬剤の代替手段となる可能性があります。薬剤による副作用(食欲不振、転倒、サルコペニア、骨粗鬆症など)や、薬剤による運動への制約に対しては、ターゲットを絞った運動プログラムで軽減することが示されています。例えば、β遮断薬を服用している患者では、心拍数ではなく自覚的運動強度を用いることが適切です。また、鎮静作用のある薬剤を服用している場合には、鎮静効果が最小限の時間に運動を行うなどの考慮が必要です。個別の運動プログラムと定期的な薬物レビューによって安全性が確保されると、処方中止や減量に繋げることができます。 ICFモデルでは、身体機能や健康状態・薬剤だけでなく、「活動」や「参加」といった生活機能が、環境因子や個人因子の影響を受け、相互に作用し合うとしています。これは、各構成要素が独立の効力を持ち、単なる疾患の反映でないことを示唆しています。健康状態・薬剤は、生活機能である栄養やリハの「相互依存性」や「相対的独立性」によって薬物療法適正化が推進します(図2)。
図2)ICFにおける相互依存性と相対的独立性
参考文献
1. Wakabayashi H. Rehabilitation pharmacotherapy: A combination of rehabilitation and pharmacotherapy. J Gen Fam Med 2018;19:43-44
2. Pazan F, Wehling M. Polypharmacy in older adults: a narrative review of definitions, epidemiology and consequences. Eur Geriatr Med. 2021 Jun;12(3):443-452.
3. Kernick D, Chew-Graham CA, O’Flynn N. Clinical assessment and management of multimorbidity: NICE guideline. Br J Gen Pract. 2017 May;67(658):235-236.
4. Ford JC, Ford JA. Multimorbidity: will it stand the test of time? Age Ageing. 2018 Jan 1;47(1):6-8.
5. Gomes F, Schuetz P, Bounoure L, et al. ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clin Nutr. 2018;37(1):336-353.
6. Izquierdo M, Pérez L, Pérez M, et al. Integrating exercise and medication management in geriatric care: a holistic strategy to enhance health outcomes and reduce polypharmacy. Lancet Healthy Longev. 2025 Sep;6(9):100763.
本記事は仲谷鈴代記念栄養改善活動振興基金の支援を受けています