著者:木下 かほり(国立長寿医療研究センター 研究所 フレイル研究部)
1.時間栄養学とは
近年注目を集めている時間栄養学は、「何をどれだけ」に「いつ」の概念を加え、体内時計を意識して、食事をする回数、タイミング、量、栄養素割合などを検討することで、疾患発症を予防し、健康寿命延伸をめざすものです。つまり、概日リズムを考慮して食事の効果を最大化する栄養学です。
2.体内時計と食事の関係
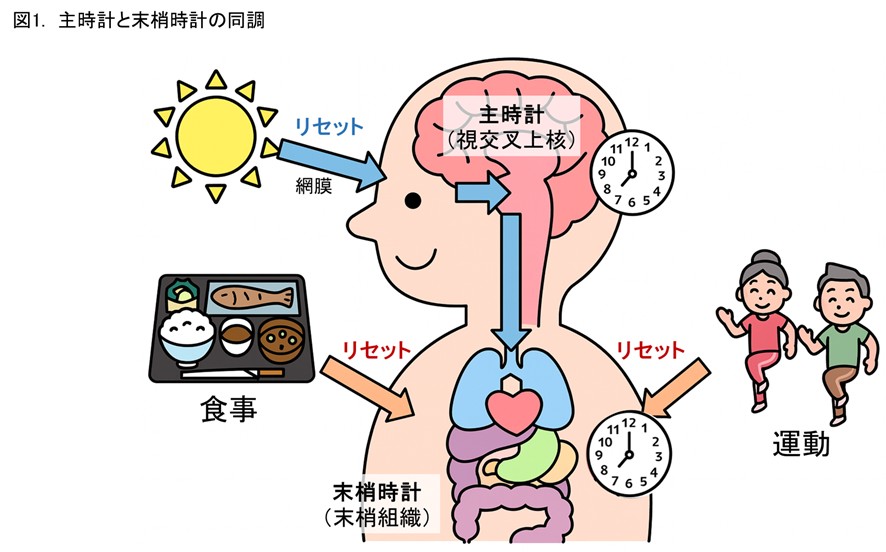
ヒトの概日リズムは地球の明暗周期24時間より長いため、体内時計をリセット(同調)して24時間に合わせる必要があります。体内時計には、脳の視交叉上核に存在する「主時計(中枢時計)」と末梢組織に存在する「末梢時計」があり、末梢時計は食事や運動により直接リセットされます(図1)。
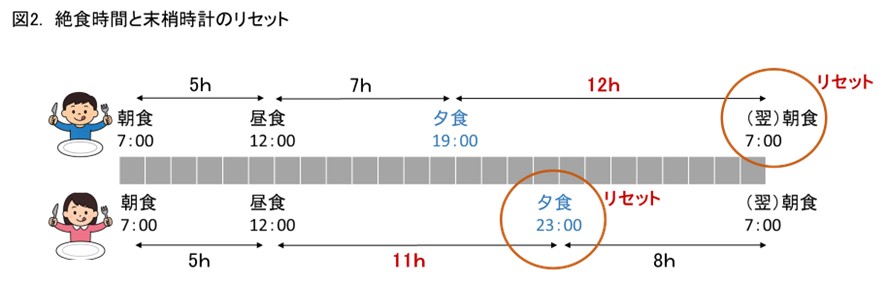
末梢時計のリセットには炭水化物とたんぱく質が関与し、1日で最も長い絶食の後の最初の食事でリセットされます。そのため、通常は朝食でリセットされますが、不規則な食事をしている人ではタイミングがずれてしまいます。夕食が遅い場合、昼食と夕食の間が最も長い絶食となり、夕食で体内時計がリセットされるという実験結果があります(図2)。このように、不規則な食事や朝食欠食は概日リズムを乱します1)。
3.体内時計の乱れと生活習慣病
概日リズムの乱れはインスリン感受性と耐糖能の低下、血圧上昇、心拍変動、炎症促進、ホルモンリズムの乱れを引き起こし、2型糖尿病や心血管疾患の発症リスクとなる可能性が明らかになっています1)。成人を対象とした疫学研究では、概日リズムの乱れが大きい人は肥満や代謝性疾患の発症率が高いことが示されています2, 3)。
4.生活習慣病とフレイル
心血管リスク因子は筋肉量減少や全身性炎症等を介してフレイルを促進すると考えられており、中年期に心血管疾患リスクが高い者では高齢期のフレイル発症が高まることが示されています4)。中年期の全身性炎症が高齢期のフレイルに関連することを明らかにした研究では、高齢期でフレイルを生じた群ではロバストを維持した群に比べて、中年期の高血圧、糖尿病、心血管疾患、心不全の罹患者が多いことを示しています5)。また、中年期に過体重/肥満の者では、高齢期のフレイルリスクが高くなります4, 6, 7)。このように、中年期の生活習慣病対策は高齢期のフレイル予防に重要であり、そのひとつに時間栄養学的なアプローチが考えられます。
5.時間栄養学的アプローチ
(1)食事時間制限(Time-Restricted Eating, TRE)
TREとは、食事を摂る時間帯を8~12時間/日程度に制限する食事療法です。
肥満患者の摂食時間を10時間以内(例:朝食7時、昼食12時、夕食17時)に制限すると3か月で平均3%体重が減少することや、メタボリックシンドロームの者のHbA1cや体重が減少するなどの報告があります3, 8, 9)。TREは加齢、不規則な食事、生活要因等によって弱まった概日リズムを回復し、代謝と心血管機能を改善すると示唆されています10, 11)。一方、TREの効果は単なるエネルギー摂取量減少によるものとの指摘もあり、長期的な効果も確立されていません。最適な摂食時間についても不明なままです。しかし、摂食時間が長くならないようにする(夜遅くに食べない)ことは、中年期の生活習慣病発症を予防するために重要でしょう。一方、高齢者のTREは筋量減少をきたすおそれも示唆されており12)、中年者と高齢者とでは影響が異なる可能性があります。今後、さらなる研究が必要です。
(2)食事タイミング
朝食の習慣的摂取と1日の早い時間帯に多くのエネルギーを摂取することは2型糖尿病、心血管疾患、肥満等のリスク低下に寄与します13)。働き世代で夕食が遅い場合は、昼食と夕食の間が長くならないよう軽食をとることで、食後高血糖とインスリン過剰分泌の抑制、概日リズムの乱れを防ぐ可能性があります。
近年、骨格筋にも末梢時計が存在することが明らかになり、たんぱく質の摂取タイミングに着目した研究が増加しています。とくに高齢者では、1日のたんぱく質配分を朝食に多くすることは骨格筋量の維持に重要な可能性が示されており14, 15)、我々の疫学調査でもたんぱく質の質の高い朝食の摂取(たんぱく質の生物学的利用能が高い朝食の摂取)は筋力維持に寄与する可能性を明らかにしています16)。
まとめ
中年期の規則正しい食事による代謝やホルモン調節の最適化は、生活習慣病予防を通して高齢期のフレイル予防にも寄与する可能性があります。時間栄養学は歴史が浅く、不明な点も多いですが、研究の発展が楽しみな分野であると考えます。
文献
1. Meléndez-Fernández OH, et al. Int J Mol Sci. 2023;24.
2. Noh J. J Obes Metab Syndr. 2018;27:78-83.
3. Duez H, et al. Curr Obes Rep. 2025;14:20.
4. Strandberg TE, et al. Int J Obes. 2012;36:1153-7.
5. Walker KA, et al. J Gerontol A Biol Sci Med Sci. 2019;74:343-9.
6. Jinnouchi H, et al. Geriatr Gerontol Int. 2025;25:889-96.
7. Ho HE, et al. J Nutr Health Aging. 2019;23:849-55.
8. Wilkinson MJ, et al. Cell Metab. 2020;31:92-104.e5.
9. Manoogian ENC, et al. Ann Intern Med. 2024;177:1462-70.
10. Manoogian ENC, et al. Ageing Res Rev. 2017;39:59-67.
11. Roth JR, et al. Obesity. 2023;31:40-9.
12. Mao Z, et al. Aging Cell. 2024;23:e14059.
13. St-Onge MP, et al. 2017;135:e96-e121.
14. Aoyama S, et al. Cell Rep. 2021;36:109336.
15. Kim HK, et al. Front Nutr. 2021;8:797004.
16. Kinoshita K, et al. J Am Med Dir Assoc. 2022;23(5):729-735.
本記事は仲谷鈴代記念栄養改善活動振興基金の支援を受けています