2025/9/22公開 著者:高木 咲穂子 (国立長寿医療研究センター 栄養管理部)
Anorexia of Aging(AA)は「高齢者の食欲低下および/または食事摂取量の減少」と定義されます。
多くの高齢者にみられ、体重減少や低栄養、フレイル、サルコペニア、生活の質の低下、さらには死亡率の増加といった不良アウトカムに直結する老年症候群の一つです。しかし実際には、“歳のせいだから仕方がない”と見過ごされ、評価や介入が十分に行われていないケースも少なくありません。本稿では、AAの要因、評価、介入における重要なポイントを解説します。
AAの定義と有病率
AAは1980年代後半にDr. Morleyにより提唱され1、国際フレイル・サルコペニア研究会議(ICFSR)では“Loss of appetite and/or low food intake in older people”=「高齢者の食欲低下および/または食事摂取量の減少」と定義されています2。つまり、加齢に伴う食欲低下だけでなく、食欲はあるものの(または低下に気づかないまま)食事摂取量が減少している状態も含まれます。AAは単なる栄養不足ではなく、適切な管理を行わなければサルコペニアやフレイル、悪液質へと進展し、入院や死亡といった不良アウトカムのリスクを高めます3(図1)。WHOのIntegrated Care for Older People (ICOPE) プログラムでも、食欲低下は栄養リスクの主要因として位置づけられ、内在的能力のスクリーニング項目に含まれています4。
図1. Anorexia of agingの要因とアウトカム(文献3)
最新のシステマティックレビューでは、日本における高齢者のAAの有病率は23%と報告され、アジアやヨーロッパ諸国と同程度の割合を示しています5。セッティング別にみると、入院患者で35%、施設入所者で31%、外来患者で24%、地域在住高齢者で21%と、健康な高齢者でも約5人に1人にAAがみられることが明らかになりました。有病率は加齢とともに上昇し、女性に多く認められます。閉経後のホルモン変化など、生理学的な性差が影響している可能性が指摘されています。
AAの評価
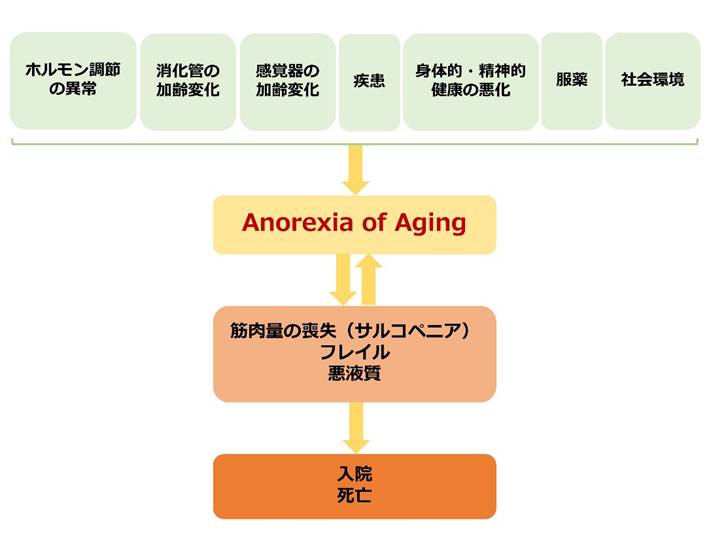
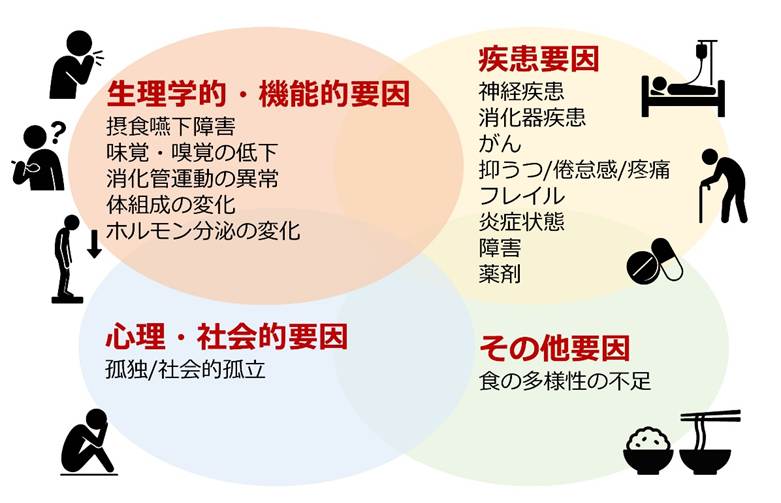
AAは生理学的・機能的要因に加え、疾患、心理・社会的要因など複数の要因が複雑に絡み合って生じます6(図2)。
図2. Appetite loss(食欲低下)の要因(文献6)
AAの管理には早期の評価が不可欠です。まずスクリーニングを行いますが、現時点でゴールドスタンダードとなる評価ツールは存在しません6。高齢者の栄養スクリーニングに用いられるMini Nutritional Assessment®-short form (MNA®-SF)、Malnutrition Screening Tool(MST)、Short Nutrition Assessment Questionnaire (SNAQ)などは、食欲低下や摂取量減少を評価項目に含んでおり、AA確認の実用的手段といえます。さらに、Council of Nutrition Appetite Questionnaire (CNAQ; 8項目)やSimplified Nutritional Appetite Questionnaire (SNAQ; 4項目)といった食欲評価ツールは、体重減少との関連も報告されています7。
スクリーニングでAAが疑われた場合、うつ病や孤独感、薬剤、副作用、歯科的問題、食事制限、摂食嚥下障害、感染症など可逆的な原因を除外することが重要です3。原因は多岐にわたるため診断推論が不可欠であり、日本リハビリテーション栄養学会のポジションペーパーでは、食欲低下のOPQRST(表1)を確認し、薬剤、嚥下障害、認知機能低下、消化器疾患、嗜好といった頻度の高い要因をすべての症例で疑うことが推奨されています8。
表1. 食欲低下の診断推論で用いるOPQRST(文献8)

AAに対する介入
AAへの介入は原因に基づく個別化された包括的アプローチが重要です。食事内容の調整、栄養補助食品(ONS)、環境調整、運動療法、薬剤調整などを組み合わせること9,10、栄養サポートチーム(NST)をはじめとする多職種連携を通じて有効性が高まります。以下に代表的な介入を示します。
<食事調整 Food manipulation>
・風味の強化:調味料(例:香辛料、ハーブ、苦味マスキング)による風味の強化は、小規模な研究で食欲や食事摂取量の改善が示唆されていますが、その効果は一貫していません。
・食事の多様性の向上:食品の食感や盛り付けの調整、食事のバリエーションを増やすことで、食欲に影響を与える可能性があります。
・食事介助:看護師や訓練されたスタッフによる食事介助は、入院患者のエネルギーおよびタンパク質摂取量を改善する効果が報告されています。
・ONSの提供:ONSの摂取は、高齢者の食欲、エネルギーや主要栄養素の摂取量増加、体重増加に対して有益な効果をもたらすことが、複数の介入試験で示されています11。食間にクッキーなどの強化食品を提供することで、食欲が改善し、体重増加と関連したという報告もあります。
・脱水予防:脱水は食欲低下と関連するため、水分(水、お茶、牛乳、ジュースなど)を好みに応じて補給することが推奨されます。
・栄養食事指導:栄養食事指導は、体重やエネルギー摂取量を改善する可能性があり、食環境や食品の選択、調理法、モチベーションなど幅広い影響を与えます。
<環境適応 Environmental adaptation>
・社会的孤立の防止と共食:孤食(食事を一人で食べること)はAAのリスク因子の一つです。病院や施設においても、ベッド上ではなく食堂等で食事をとることが望まれます。
・食事環境の調整:食事に費やす時間、静かで落ち着いた環境、団らんやポジティブな雰囲気の促進、明るい場所の確保などが、高齢者の食欲改善に寄与することが示されています。
<薬剤の見直し Medication>
ポリファーマシー(多剤併用)は薬剤誘発性食欲不振のリスクを高める可能性があります。特に、食欲低下や体重減少を促す可能性のある薬剤を特定し、可能であれば減薬や休薬を考慮します。
例)・心血管系薬剤:ジゴキシン、アミオダロン、スピロノラクトンなど
・精神科薬剤:フェノチアジン、リチウム、アミトリプチリン、フルオキセチンなど
・抗リウマチ薬:非ステロイド性抗炎症薬など
<基礎疾患の治療 Medical diagnoses>
体重減少に関わる可能性のある全ての医学的原因を評価し、特異的に対処します。
例)嚥下障害、消化吸収不良、神経学的疾患、内分泌障害、精神疾患、呼吸器疾患、心血管疾患など
<運動 Exercise>
単独の運動プログラムでは食欲に有意な効果がないという報告もありますが、身体活動量は食欲に関わっています。レジスタンストレーニングなどの運動は、栄養介入と組み合わせることで有益な可能性があります。
<食欲に対する薬剤>
食欲を刺激する薬剤(コルチコステロイド、成長ホルモン、同化ステロイド、メトクロプラミド、メゲストロール酢酸塩など)が検討されていますが、副作用が多いため、日常的な臨床実践では推奨されていません2。
今後の課題
AAの評価や管理においては、標準化された評価法の確立、医療従事者への継続教育、介入研究によるエビデンス構築が課題です。現在用いられている主観的評価ツールは研究目的で使われることが多く、臨床実践への導入には専門家によるコンセンサスと医療従事者の理解が欠かせません。高齢者医療に関わる医療従事者を対象とした国内の調査では、栄養に関する継続教育プログラムへの参加の有無により、AAの評価や治療実践に大きな差があることが示されました12。特に教育機会のない群では、AAスクリーニングに特定のツールを用いない、ガイドラインに基づかないケアを行う割合が高い傾向にありました(図3)。教育機会を拡充し、質の高いエビデンスに基づいたガイドラインの普及を進める必要があります。
図3. 教育機会の有無によるAAの評価とケアの比較(文献12改変)
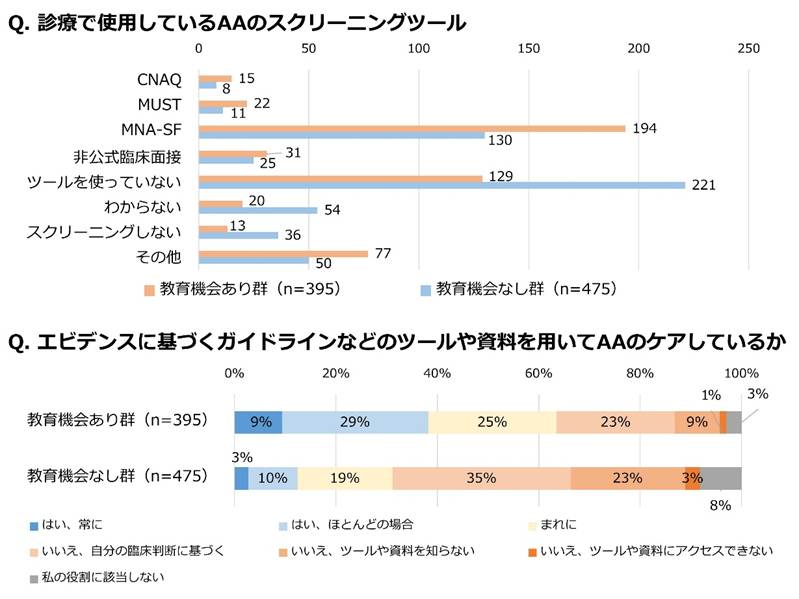
また、AAに対するケアでは、長期的効果の検証や多角的介入の有効性を評価する大規模研究が不足しています。前述の国内調査でも“質の高いエビデンスがないため治療を開始しにくい”と答えた者が半数を超えており、介入の遅れが課題です12。AAに関する理解とエビデンスは依然として不十分であり、実践を支える指針も限られています。今後は教育体制の充実と標準化評価法の普及、多職種連携による大規模かつ長期的な介入研究が求められます。これらの取り組みにより、AAに対する科学的根拠に基づく予防・治療戦略が整備され、高齢者の健康に大きく寄与することが期待されます。
参考文献
1. Morley JE, Silver AJ. Anorexia in the elderly. Neurobiol Aging 1988; 9: 9–16.
2. de Souto Barreto P, Cesari M, Morley JE, Roberts S, Landi F, Cederholm T, et al. Appetite Loss and Anorexia of Aging in Clinical Care: An ICFSR Task Force Report. J Frailty Aging 2022; 11: 129–34.
3. Merchant RA, Woo J, Morley JE. Editorial: Anorexia of Ageing: Pathway to Frailty and Sarcopenia. J Nutr Health Aging 2022; 26: 3–5.
4. 一般社団法人日本老年医学会. 日本語版 ICOPE ハンドブック. [cited 2025 Sep 19]. Available from: https://www.jpn-geriat-soc.or.jp/publications/other/icope_handbook.html
5. Fernandez SSM, Cipolli GC, Merchant RA, Moreira VG, Klompenhouwer T, Pain A, et al. Global prevalence of anorexia of aging: A systematic review and meta-analysis. Maturitas 2025; 198: 108603.
6. de Souto Barreto P, Cesari M, Morley JE, Gonzalez-Bautista E, Rolland Y, Azzolino D, et al. Assessment and Management of Appetite Loss in Older Adults: An ICFSR Task Force Report. J Frailty Aging 2023; 12: 1–6.
7. Wilson M-MG, Thomas DR, Rubenstein LZ, Chibnall JT, Anderson S, Baxi A, et al. Appetite assessment: simple appetite questionnaire predicts weight loss in community-dwelling adults and nursing home residents. Am J Clin Nutr 2005; 82: 1074–81.
8. 若林秀隆, 前田圭介, 百崎 良, 小蔵要司, 吉村芳弘, 藤原 大, 他. リハビリテーション栄養における診断推論:日本リハビリテーション栄養学会によるポジションペーパー. リハビリテーション栄養 2022; 6: 2–11.
9. Cox NJ, Ibrahim K, Sayer AA, Robinson SM, Roberts HC. Assessment and Treatment of the Anorexia of Aging: A Systematic Review. Nutrients 2019; 11.
10. Landi F, Calvani R, Tosato M, Martone AM, Ortolani E, Savera G, et al. Anorexia of Aging: Risk Factors, Consequences, and Potential Treatments. Nutrients 2016; 8: 69.
11. Li M, Zhao S, Wu S, Yang X, Feng H. Effectiveness of Oral Nutritional Supplements on Older People with Anorexia: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients 2021; 13.
12. Takagi S, Satake S, Sugimoto K, Kuzuya M, Akishita M, Arai H, et al. Survey on the knowledge and practices in anorexia of aging diagnosis and management in Japan. J Cachexia Sarcopenia Muscle 2024; 15: 2164–74.
本記事は仲谷鈴代記念栄養改善活動振興基金の支援を受けています